摘要:從中藥新藥研發(fā)的實(shí)踐角度出發(fā)�,圍繞《基于人用經(jīng)驗(yàn)的中藥復(fù)方制劑新藥臨床研發(fā)指導(dǎo)原則》的核心內(nèi) 容��,結(jié)合相關(guān)的政策法規(guī)���、指導(dǎo)原則�,重點(diǎn)分析和討論人用經(jīng)驗(yàn)的內(nèi)涵��、基于人用經(jīng)驗(yàn)中藥新藥的研發(fā)計(jì)劃�����,并對(duì)人用 經(jīng)驗(yàn)其他可能應(yīng)用情形提出建議與思考���,以期為采用人用經(jīng)驗(yàn)進(jìn)行中藥新藥研發(fā)的業(yè)內(nèi)同仁提供參考�����。
為促進(jìn)中醫(yī)藥傳承創(chuàng)新發(fā)展,深化中藥新藥注 冊(cè)審評(píng)體系的建設(shè) ��,加速中藥新藥的審批上市���,相繼發(fā)布了一系列文件[1-3]����,要求“構(gòu) 建中醫(yī)藥理論�����、人用經(jīng)驗(yàn)和臨床試驗(yàn)相結(jié)合的中藥 注冊(cè)審評(píng)證據(jù)體系”(“三結(jié)合”)��。國(guó)家藥品監(jiān)督管 理局藥品審評(píng)中心(CDE)為明確“三結(jié)合”審評(píng)證據(jù) 體系的相關(guān)技術(shù)要求,于 2022 年 4 月正式發(fā)布《基 于人用經(jīng)驗(yàn)的中藥復(fù)方制劑新藥臨床研發(fā)指導(dǎo)原 則》(以下簡(jiǎn)稱《指導(dǎo)原則》)����,其主要特點(diǎn)為充分考 慮中藥的特點(diǎn)、研發(fā)規(guī)律和實(shí)際情況��,將真實(shí)世界 研究的設(shè)計(jì)方法引入研發(fā)策略之中��,針對(duì)不同的注 冊(cè)分類及人用經(jīng)驗(yàn)的收集情況�����,推薦相應(yīng)的研發(fā)路 徑[4] �����。為更好地加速中藥注冊(cè)審評(píng)����,減少研發(fā)費(fèi)用及 社會(huì)資源的浪費(fèi)�����,優(yōu)選研發(fā)路徑是基于人用經(jīng)驗(yàn)中 藥新藥研發(fā)的關(guān)鍵 ,而人用經(jīng)驗(yàn)研究的完整性��、充 分性是保障研發(fā)路徑選擇正確��、合理的基石。
筆者從中藥研發(fā)的實(shí)踐角度出發(fā),以指導(dǎo)原則 所推薦的研發(fā)策略為核心 ���,梳理相關(guān)政策法規(guī)����,結(jié) 合本團(tuán)隊(duì)中藥研發(fā)的臨床實(shí)踐經(jīng)歷�,對(duì)于研發(fā)中涉 及的人用經(jīng)驗(yàn) 、研發(fā)計(jì)劃及其他可能應(yīng)用的情形, 提出自己的分析與思考�,供同道借鑒與參考�。
1 人用經(jīng)驗(yàn)
在“ 三結(jié)合”注冊(cè)審評(píng)證據(jù)體系的概念被提出 之后���,國(guó)內(nèi)相關(guān)機(jī)構(gòu)�、業(yè)內(nèi)專家相繼發(fā)表了對(duì)人用 經(jīng)驗(yàn)的認(rèn)識(shí) 。孫昱認(rèn)為,“ 中藥是以人體實(shí)踐為研發(fā) 起點(diǎn)����,中藥新藥復(fù)方制劑大多具有既往臨床應(yīng)用經(jīng) 驗(yàn)��,即具有可供評(píng)價(jià)的人用經(jīng)驗(yàn)”[5-6],此外還探索了 人用經(jīng)驗(yàn)證據(jù)的分級(jí)與申報(bào)資料減免的關(guān)系 ?����!吨?/span> 藥注冊(cè)管理專門規(guī)定(征求意見(jiàn)稿)》在“合理使用 人用經(jīng)驗(yàn)證據(jù)”一節(jié)中���,將其概括為“在長(zhǎng)期臨床實(shí) 踐中積累的用于滿足臨床需求 �����,具有一定規(guī)律性��、 可重復(fù)性的關(guān)于中醫(yī)臨床診療認(rèn)識(shí)的概況總結(jié)”[7]�����。 張曉雨等[8]認(rèn)為���,“ 中藥人用經(jīng)驗(yàn)不僅指在長(zhǎng)期臨床 實(shí)踐中積累的關(guān)于中醫(yī)臨床診療認(rèn)識(shí)的概括總結(jié)���, 而且需要有一定說(shuō)服力的臨床數(shù)據(jù)作為支撐”�,在 突出臨床數(shù)據(jù)的同時(shí)�,還建議應(yīng)首先建立人用經(jīng)驗(yàn) 證據(jù)的分級(jí)評(píng)價(jià)標(biāo)準(zhǔn),以便更好地指導(dǎo)人用經(jīng)驗(yàn)證 據(jù)的積累與應(yīng)用�����。楊忠奇等[9-10]將人用經(jīng)驗(yàn)分為人用 經(jīng)驗(yàn)資料、人用經(jīng)驗(yàn)數(shù)據(jù)和人用經(jīng)驗(yàn)證據(jù),強(qiáng)調(diào)基 于人用經(jīng)驗(yàn)證據(jù)的評(píng)價(jià) ���。可見(jiàn)����,人用經(jīng)驗(yàn)的概念和 內(nèi)容相對(duì)較廣泛,且認(rèn)識(shí)不盡一致。
本《指導(dǎo)原則》將人用經(jīng)驗(yàn)定義為“ 中藥處方/制 劑在臨床用藥過(guò)程中積累的對(duì)其適用人群��、用藥劑 量、療效特點(diǎn)和臨床獲益的認(rèn)識(shí)和總結(jié)”[4]���,進(jìn)一步 將人用經(jīng)驗(yàn)與藥品上市所需回答的關(guān)鍵問(wèn)題相互 關(guān)聯(lián)��,并特別指出��,其所側(cè)重的是如何基于人用經(jīng) 驗(yàn)產(chǎn)生支持監(jiān)管決策的證據(jù)[4,11]��,即人用經(jīng)驗(yàn)證據(jù)���, 其形成過(guò)程依托于臨床研究和文獻(xiàn)研究 �。各種研究類型,無(wú)論是前瞻性研究還是回顧性研究,試驗(yàn)性 研究還是觀察性研究����,均可產(chǎn)生支持下一步研究或 注冊(cè)審評(píng)相關(guān)的證據(jù) 。人用經(jīng)驗(yàn)證據(jù)不僅僅指有效 性和安全性�,也包含與申報(bào)目標(biāo)相關(guān)性和一致性的 證據(jù)。例如,可采用基于醫(yī)院信息系統(tǒng)(HIS)的數(shù)據(jù) 挖掘����,可初步獲取適用人群與用法用量[12],為后續(xù)研 究的設(shè)計(jì)提供證據(jù)支持�����;對(duì)于同一 品種,在長(zhǎng)期的 人用歷史中,可形成豐富的人用經(jīng)驗(yàn)證據(jù),例如多 個(gè)適應(yīng)癥�,多個(gè)適用人群等�,建議對(duì)相關(guān)證據(jù)進(jìn)行 整理��,確保適用人群����、干預(yù)措施���、適應(yīng)癥與申報(bào)目標(biāo) 相一致���。
對(duì)于人用經(jīng)驗(yàn)證據(jù)的評(píng)估,本《指導(dǎo)原則》并未 直接采用循證醫(yī)學(xué)的證據(jù)分級(jí)標(biāo)準(zhǔn) [如 GRADE 分 級(jí)[13]�、牛津循證醫(yī)學(xué)中心分級(jí)(OCEBM)標(biāo)準(zhǔn)等]作為 評(píng)估依據(jù)��,但其仍具有重要的參考價(jià)值 。人用經(jīng)驗(yàn) 證據(jù)的充分性���,不僅要回答注冊(cè)審評(píng)所需的科學(xué)問(wèn) 題���,以及問(wèn)題的類型、多少和程度�,而且還涉及擬研 發(fā)品種的社會(huì)需求問(wèn)題 �����。不同適用病種對(duì)證據(jù)的需 求也不盡相同�,對(duì)于特殊類型�����,例如罕見(jiàn)病 、危重 病,或涉及重大公共衛(wèi)生的病種,或?qū)儆谑袌?chǎng)短期����、 社會(huì)急需等情形��,單個(gè)臨床研究也可能成為強(qiáng)有力 的人用經(jīng)驗(yàn)證據(jù), 然而中藥一般多用于常見(jiàn)疾病���, 此類情況相對(duì)較少���; 對(duì)于已有多種治療選擇的病 種�����,例如普通感冒��,可能需要提供一種或多種高質(zhì) 量的研究,才能形成較強(qiáng)的人用經(jīng)驗(yàn)證據(jù) �。對(duì)于 3.2 類(其他來(lái)源于古代經(jīng)典名方的中藥復(fù)方制劑����,下 同)中藥而言��,完善的中醫(yī)理論和高質(zhì)量的中醫(yī)臨 床實(shí)踐,也可滿足相應(yīng)的證據(jù)需求[14]。
2 研發(fā)計(jì)劃
確定臨床研發(fā)計(jì)劃是保障藥物研發(fā)順利實(shí)施 很為關(guān)鍵的內(nèi)容之一 ���?���;谌擞媒?jīng)驗(yàn)中藥新藥的臨 床研發(fā)可分為 2 個(gè)階段,本《指導(dǎo)原則》根據(jù)與監(jiān)管 機(jī)構(gòu)溝通交流獲得臨床研究許可�����,或達(dá)成共識(shí)的時(shí) 間���,分為“既往”階段和“將來(lái)”階段�。“既往”階段的 主要內(nèi)容為人用經(jīng)驗(yàn)臨床研究,其研究類型既可以 是回顧性設(shè)計(jì),也可有前瞻性設(shè)計(jì),而在“將來(lái)”中�����, 均為前瞻性設(shè)計(jì) 。研發(fā)計(jì)劃的重點(diǎn)在于依據(jù)“既往 ” 選擇“將來(lái)”����,即基于人用經(jīng)驗(yàn)研究的信息強(qiáng)弱,優(yōu) 選相應(yīng)的研發(fā)路徑 �?���!吨笇?dǎo)原則》以中藥注冊(cè)分類為 依托�,推薦了 7 條臨床研發(fā)路徑,見(jiàn)表 1 ��。關(guān)于路徑 的選擇����,對(duì)于申辦者而言�����,其目的在于盡早爭(zhēng)取注 冊(cè)上市���,或終止研發(fā)��,從而減少資源�����、時(shí)間和成本的花費(fèi)�����。
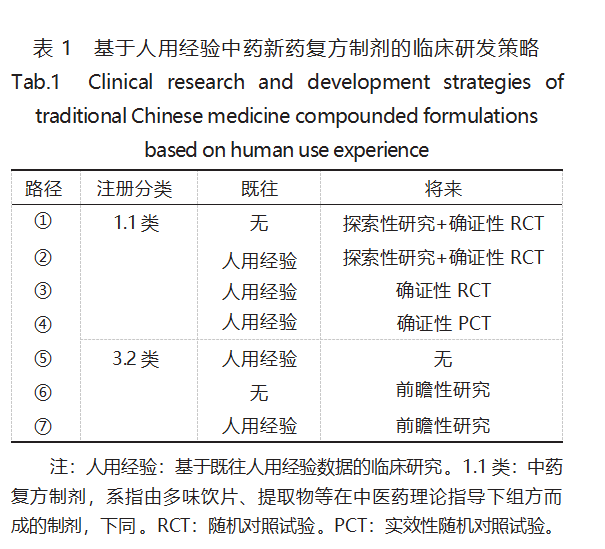
2.1 既往研究 既往研究�, 也可稱為人用經(jīng)驗(yàn)研 究�,即與 CDE 溝通交流前所有已完成的研究���,大多 由研究者主動(dòng)發(fā)起 ���。對(duì)于申辦者而言,可以整理已 有的人用經(jīng)驗(yàn),直接進(jìn)行溝通申請(qǐng)�����,選擇相應(yīng)的研 發(fā)路徑���,也可以繼續(xù)進(jìn)行人用經(jīng)驗(yàn)研究,采用回顧 性或前瞻性的設(shè)計(jì)��,補(bǔ)充完善人用經(jīng)驗(yàn)證據(jù)����,進(jìn)而 選擇相對(duì)簡(jiǎn)單的“將來(lái)”研究路徑�����,或直接申請(qǐng)注 冊(cè) 。對(duì)于 1.1 類 ,人用經(jīng)驗(yàn)研究主要提供探索性證 據(jù)�,對(duì)于 3.2 類而言�,人用經(jīng)驗(yàn)研究可以是探索性證 據(jù)���,也可是確證性證據(jù)�����。
人用經(jīng)驗(yàn)研究的設(shè)計(jì)方法可以是任何類型,對(duì) 于臨床研究���, 推薦采用真實(shí)世界研究的設(shè)計(jì)方法��, 既符合中藥臨床實(shí)踐應(yīng)用特點(diǎn)���,也有利于在真實(shí)醫(yī) 療環(huán)境中�, 探索研發(fā)品種的臨床定位及效應(yīng)估計(jì)�����。 設(shè)計(jì)類型大致分為 A[隨機(jī)對(duì)照試驗(yàn)(RCT)或?qū)嵭?/span> 性隨機(jī)對(duì)照試驗(yàn)(PCT)]、B(有外部對(duì)照的單臂試 驗(yàn)���、前瞻性隊(duì)列研究)��、C(病例對(duì)照研究、回顧性隊(duì) 列研究)、D(病例報(bào)告��、病例系列��、橫斷面研究)4 類���。 對(duì)于 1.1 類中藥�,若選擇路徑③或④ , 建議人用經(jīng) 驗(yàn)研究至少包含 B 或 A 類 �����。對(duì)于 3.2 類�,若選擇路 徑⑤ , 一般來(lái)說(shuō)��,人用經(jīng)驗(yàn)研究至少應(yīng)為有對(duì)照的研究。
數(shù)據(jù)的可溯源性是人用經(jīng)驗(yàn)研究的重點(diǎn)和關(guān) 鍵 ?�?伤菰粗傅氖强商峁┰嫉牟v記錄�,或源數(shù) 據(jù)庫(kù)�����;若不可溯源�,僅能提供研究的總結(jié)���,可進(jìn)行文 獻(xiàn)研究��,但其所能提供的證據(jù)較弱��,或可作為支持 后續(xù)研究設(shè)計(jì)的證據(jù) 。此外���,數(shù)據(jù)治理和質(zhì)量評(píng)估 也是人用經(jīng)驗(yàn)研究必不可少的步驟,其目的在于提 高人用經(jīng)驗(yàn)研究的可靠性和與申報(bào)目標(biāo)的一致性�����。
例如,在 1 項(xiàng)或多項(xiàng)人用經(jīng)驗(yàn)研究(包括 RCT)中, 若申報(bào)目標(biāo)僅為其亞組,需經(jīng)過(guò)數(shù)據(jù)治理后,評(píng)估 其有效性證據(jù)����,安全性可采用全部人群的結(jié)果����。
2.2 將來(lái)研究 將來(lái)研究��, 是與 CDE 溝通交流獲 得許可后的臨床研究,必須采用前瞻性設(shè)計(jì)����,對(duì)于 不同的情形����,須采用相應(yīng)的設(shè)計(jì)方法�。
對(duì)于 1.1 類��,《指導(dǎo)原則》推薦了 4 條研發(fā)路徑����。 路徑①,屬于無(wú)人用經(jīng)驗(yàn)的情形���,本文不過(guò)多贅述����。 路徑② , 人用經(jīng)驗(yàn)證據(jù)較弱���,僅能回答與申報(bào)目標(biāo) 相關(guān)的問(wèn)題�,例如適應(yīng)癥定位,用法用量等,可為后 續(xù)研究的設(shè)計(jì)提供證據(jù)支持,在溝通交流獲得許可 后,需再進(jìn)行探索性研究和確證性的 RCT �。探索性 研究的類型,可以是干預(yù)性的��,也可是觀察性的��,根 據(jù)具體品種的情況�,建議選擇 RCT�、PCT�、前瞻性隊(duì) 列研究���、單臂試驗(yàn)中的 1 種或多種 。路徑③和路徑 ④相近����,人用經(jīng)驗(yàn)證據(jù)充分�����,結(jié)果積極或趨勢(shì)明顯, 能為確證性研究的設(shè)計(jì)和樣本量估算提供有力支 持,可以直接開(kāi)展確證性的 RCT 或 PCT ���。對(duì)于選擇 RCT 還是 PCT,筆者認(rèn)為�,若目標(biāo)人群范圍較廣,盲 法難以開(kāi)展,或適用病種復(fù)雜,目前暫無(wú)有效的治 療措施�,或中藥為綜合治療方案中的 1 種,或嚴(yán)格控制下的 RCT 實(shí)施困難等,建議選擇 PCT�����。此外��,還 要考慮人用經(jīng)驗(yàn)證據(jù)與后續(xù)研究類型的相關(guān)性 和一致性,例如,若已有的人用經(jīng)驗(yàn)證據(jù)為相對(duì)嚴(yán) 格的臨床研究�,后續(xù)研究則不建議采用寬泛的 PCT研究。
對(duì)于 3.2 類,《指導(dǎo)原則》推薦了 3 條研發(fā)路徑�����。 路徑⑥為無(wú)人用經(jīng)驗(yàn)證據(jù)的情形�,需通過(guò)前瞻性研 究獲得足夠的證據(jù)支持注冊(cè) ��。前瞻性研究可以是干 預(yù)性的���,也可以是觀察性的�,其將來(lái)研究的設(shè)計(jì)可 以選擇前瞻性病例系列研究 ����、前瞻性隊(duì)列研究����、單 臂臨床試驗(yàn)、RCT����、PCT 中的 1 種或多種 ��。路徑⑤和 路徑⑦均為有人用經(jīng)驗(yàn)證據(jù)的路徑 ,結(jié)果可靠�、證 據(jù)充分,可選擇路徑⑤ , 直接申請(qǐng)注冊(cè)�����;證據(jù)不足�����, 則需進(jìn)一步開(kāi)展前瞻性研究,獲取足夠的證據(jù)支持 注冊(cè)申請(qǐng)��,設(shè)計(jì)類型可參考路徑⑥。
3 其他應(yīng)用情形
“ 異病同治�����、同病異治”是中藥治療特點(diǎn)之一����, 隨著人用經(jīng)驗(yàn)的積累�����,中成藥超說(shuō)明書用藥成為一 種常態(tài)����,為更好地規(guī)范用藥�����,上市后變更研究必不 可少 ����。其次�,中藥研發(fā)的目的也常涉及提高臨床用 藥的順應(yīng)性��、降低用藥風(fēng)險(xiǎn)、節(jié)約社會(huì)資源���、保護(hù)珍 貴中藥材的國(guó)家政策法規(guī)等情形����,改良型新藥或變更的研發(fā)需求也相對(duì)較多 �����。盡管本《指導(dǎo)原則》僅列 舉了 1.1 類和 3.2 類的的研發(fā) �,未涉及已上市中藥 變更(如變更適用人群范圍����、變更用法用量等)和改 良型新藥(如增加功能主治)等情形��,考慮到《基于 “ 三結(jié)合 ”注冊(cè)審評(píng)證據(jù)體系下的溝通交流指導(dǎo)原 則(試行)》中提到改良型新藥、已上市中藥變更等 情形,可參考 1.1 中藥復(fù)方制劑,提出溝通交流申 請(qǐng)[15]����,筆者認(rèn)為人用經(jīng)驗(yàn)證據(jù)也可用于此類中藥的 研發(fā)����,建議在收集整理已有的人用經(jīng)驗(yàn)證據(jù)后���,積 極與 CDE 提出溝通交流���,討論后續(xù)研究策略 ���。關(guān)于 研發(fā)策略的考慮�����,結(jié)合相關(guān)政策法規(guī),提出以下幾 點(diǎn)思考。
對(duì)于 2.1 類 ,改給藥途徑的品種�����,《中藥注冊(cè)管 理專門規(guī)定(征求意見(jiàn)稿)》中要求至少應(yīng)進(jìn)行Ⅲ期 臨床試驗(yàn)[7]�,若基于人用經(jīng)驗(yàn)研發(fā)�,建議至少進(jìn)行原 給藥途徑對(duì)照的確證性研究,可選擇路徑③或④。
對(duì)于 2.3 類�,增加功能主治�����,或上市后變更人群 范圍的品種��,建議參照 1.1 類和 3.2 類的研發(fā)策略�, 基于人用經(jīng)驗(yàn)證據(jù)的支持力度�,優(yōu)選 7 條路徑中的 1 種進(jìn)行實(shí)施����。
對(duì)于變更用法用量的品種,根據(jù)《已上市中藥 變更事項(xiàng)及申報(bào)資料要求》�,若療程和劑量無(wú)明顯 變化�����,或療程縮短、劑量降低者�,至少應(yīng)進(jìn)行變更前 后對(duì)照的確證性臨床試驗(yàn)�;若療程延長(zhǎng)、劑量增加���, 需按照新藥處理[16]?����;谌擞媒?jīng)驗(yàn)研發(fā)時(shí),前者可考 慮選擇路徑⑤,研究設(shè)計(jì)則采用變更前后對(duì)照的前 瞻性設(shè)計(jì)�����,后者建議參考 1.1 類����,在路徑① ~ ④中選 擇 。關(guān)于兒童用法用量的細(xì)化或完善���,例如“兒童酌 減”“在醫(yī)師的指導(dǎo)下應(yīng)用”等,建議優(yōu)先考慮路徑 ⑤~ ⑦。
對(duì)于 2.2 類改劑型 ,替代或減去有毒性或者瀕 危的藥味和品種�����,可積極開(kāi)展原制劑的人用經(jīng)驗(yàn)研 究����,獲得良好的數(shù)據(jù)作為對(duì)照,為后續(xù)研究的設(shè)計(jì) 提供支持[17]��。
4 小結(jié)
目前�,“三結(jié)合”注冊(cè)審評(píng)證據(jù)體系仍處于構(gòu)建 和完善的過(guò)程中 。一般認(rèn)為����,中醫(yī)藥理論主要指對(duì) “ 理法方藥”合理性的解釋,是中藥復(fù)方制劑臨床應(yīng) 用的依據(jù)���,也是開(kāi)展人用經(jīng)驗(yàn)研究和(或)臨床試驗(yàn) 的理論支撐����。人用經(jīng)驗(yàn)是中藥處方/制劑在臨床實(shí)踐 中積累的認(rèn)識(shí)與總結(jié)���,本《指導(dǎo)原則》實(shí)際上是指可 以產(chǎn)生支持下一步階段研究或監(jiān)管決策的人用經(jīng) 驗(yàn)證據(jù) �。臨床試驗(yàn)是中��、西創(chuàng)新藥研發(fā)的必經(jīng)環(huán)節(jié),其產(chǎn)生的確證性證據(jù)是支持新藥上市的主要依據(jù)����。 中醫(yī)藥理論、人用經(jīng)驗(yàn)和臨床試驗(yàn)的互相支撐��、相互 協(xié)同,可以充分利用中醫(yī)藥來(lái)源于臨床的傳統(tǒng)優(yōu)勢(shì), 節(jié)約臨床試驗(yàn)資源�����,加速中藥新藥的產(chǎn)業(yè)化進(jìn)程。
本《指導(dǎo)原則》闡述了人用經(jīng)驗(yàn)支持中藥復(fù)方 制劑新藥研發(fā)的主要原則和方法����,是對(duì)中藥新藥研 發(fā)策略的一次變革式突破與創(chuàng)新 ��。其鼓勵(lì)申辦者采 用真實(shí)世界研究等方法����,治理臨床積累的人用經(jīng)驗(yàn) 數(shù)據(jù)����,使之形成人用經(jīng)驗(yàn)證據(jù),為中藥新藥研發(fā)提 供支持,充分彰顯了中醫(yī)藥“ 源于臨床,歸于臨床 ” 的特點(diǎn) �。本文對(duì)《指導(dǎo)原則》中的人用經(jīng)驗(yàn)、研發(fā)計(jì) 劃進(jìn)行了分析和解讀����;基于中藥注冊(cè)的類別和品種 的特點(diǎn)以及人用經(jīng)驗(yàn)證據(jù)的充分程度,提出了相應(yīng) 的研發(fā)策略��;對(duì)于其中未提及的注冊(cè)類別,如 2.1~ 2.3 類中藥改良型新藥����,筆者參考相關(guān)政策法規(guī),進(jìn)行了逐一分析和討論,提出了相應(yīng)的研發(fā)路徑選擇 策略����,以供業(yè)內(nèi)同仁參考�����。
